最近,软凝聚态物理及交叉研究中心的丁泓铭-马余强课题组在DNA纳米材料与细胞相互作用方面取得重要进展,最新研究成果以“DNA Nanostructure-Programmed Like-Charge Attraction at the Cell-Membrane Interface”为题发表在ACS Central Science [IF:11.23,每年仅发表不到200篇](DOI:10.1021/acscentsci.8b00383)。该工作与上海应用物理研究所/上海交通大学的樊春海研究员合作,通过结合理论模拟与实验,揭示了DNA纳米材料与细胞相互作用的普适规律。丁泓铭副教授是论文的第一作者,马余强教授是论文的共同通讯作者。
在这项工作中,我们首先合成了棱长为20 bp的正四面体DNA纳米结构(TDN-20)。细胞实验表明,TDN-20可以通过小窝蛋白介导的内吞作用高效地进入癌细胞中。接着通过计算机模拟,我们发现,TDN-20往往采用角攻击的方式接触细胞膜,同时在进入细胞过程中倾向于选择负电性较低的区域。值得一提的是,与带负电的球形纳米粒子(无法进行角攻击)相比,TDN-20的摄取效率是它的2倍以上。此外,我们进一步证实了角攻击和区域选择性在DNA纳米结构与细胞相互作用过程中的普适性,即无论DNA纳米结构的尺寸和形状如何改变,这两种方式都普遍存在(图1A-D)。不过由于形状的改变,DNA纳米结构的角攻击能力有可能发生变化,从而在一定程度上会影响其细胞摄取效率(图1E)。
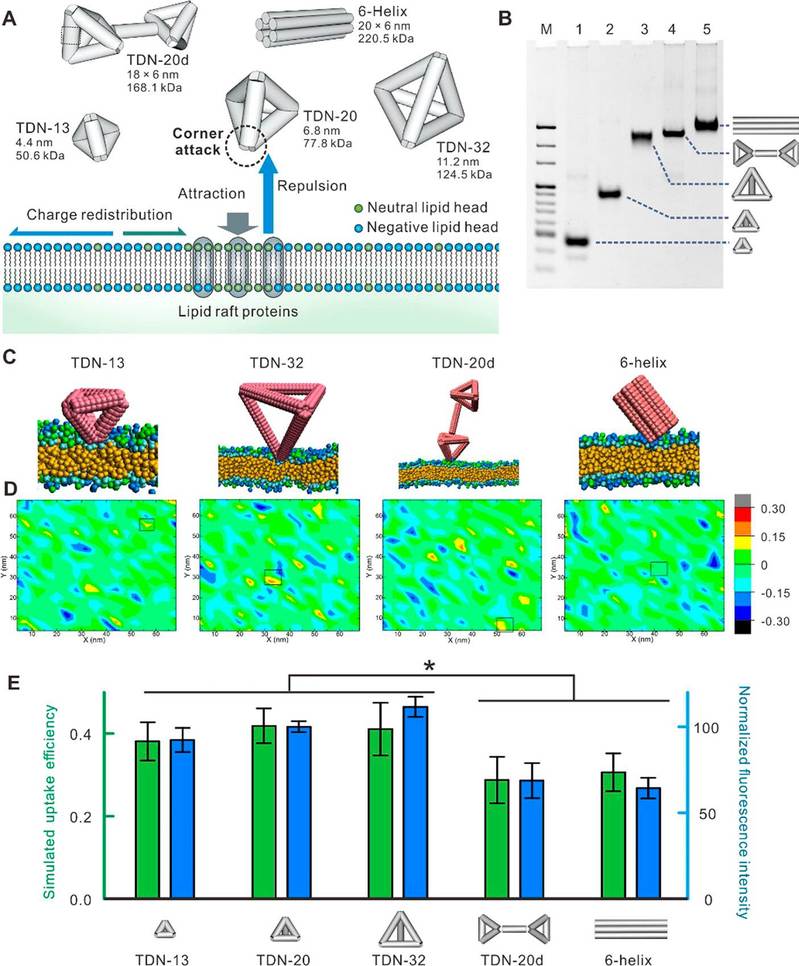
图1.不同尺寸、形状DNA纳米结构进入细胞的方式及其细胞摄取效率对比。
在论文发表的同一天,国际DNA纳米材料领域著名专家,美国埃默里大学Yonggang Ke教授应邀对本文配以专门评述(DOI:10.1021/acscentsci.8b00600)。他高度评价了我们的文章,并指出这是第一篇研究DNA纳米结构与细胞相互作用的模拟工作——“the excellent work reported here as it represents thefirst example of utilizing computational modeling to probe the cellular uptake of DNA nanostructures and paves the way for future studies.”
近两年来,该课题组积极寻求理论模拟与实验的紧密结合,包括与南京大学化学化工禁漫天堂 郑丽敏教授团队合作[Nat. Commun. 8,2131 (2017)],从理论模拟角度首次给出了实验中发现的配位聚合物手性螺旋形成的内在机理,这对进一步认识生物体系中手性的起源有着重要的指导意义(图2A);与复旦大学高分子科学系陈国颂教授团队合作[Angew. Chem. Int. Chem. 56, 10691 (2017)](Back Cover, Hot Paper),在微观和介观尺度深入研究了小分子调控蛋白质-蛋白质间相互作用的物理机制,揭示了影响蛋白质自组装的关键因素(图2B)。
图2.纳米-生物界面作用方面的其他重要进展。
此外,通过计算机模拟,该课题组还系统研究了修饰两种配体的纳米粒子的细胞内吞行为,成功解释了之前实验中发现的修饰两种配体的纳米粒子并不比修饰一种配体的纳米粒子输运效率要高(1+1≤1)的原因[Nanoscale 9, 8982 (2017)](Back Cover,图2C)。最近,我们还从模拟角度设计了一种新型的含有纳米粒子的聚合物底板,能够高效地区分癌细胞和正常细胞(已被Nanoscale接收,Doi:10.1039/c8nr06340k,并被邀请做封面)。正因为在纳米-生物界面作用方面的系统性工作,我们近期也应邀在[Nanoscale Horizons 3, 6 (2018)] (Back Cover,图2D)撰写了一篇综述,从理论模拟角度详细讨论了纳米粒子与细胞膜、蛋白质、DNA/RNA等相互作用的内在物理机制及引起纳米毒性的主要因素。该综述发表后也迅速得到了国内外同行的广泛关注,目前已入选了ESI Highly Cited Paper。


